Visszaadni a látás élményét
A környezetünkből származó ingerek jelentős részét (nagyjából nyolcvan százalékát) képi stimulusok formájában érzékeljük látórendszerünkkel. Az érzékelés folyamatának első lépése a szemünkben található ideghártya, a retina segítségével zajlik, ami miatt a retinát a fényképezőgépek fényérzékeny chipjeihez szokás hasonlítani.
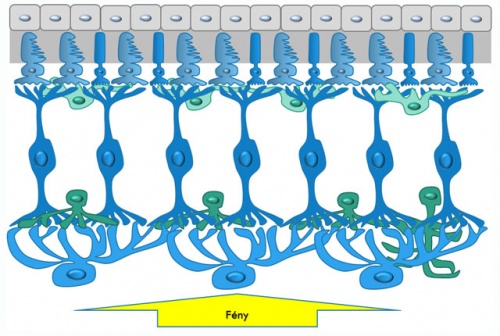 Retinális keresztmetszeti séma mutatja a fényingert felfogó (fotoreceptor – felső kék sejtsor) és az információt a retinán belül (bipoláris – középső kék sejtsor), valamint a retinától az agy felé továbbító (dúcsejt – alsó kék sejtsor) idegsejteket. Az információ tér/időbeli mintázatainak kialakításában szintén fontosak az oldalirányú gátló kapcsolatokat biztosító horizontális (felső zöld) és amakrin (alsó zöld) sejtek szerepe. A szürkével jelöltek a fotoreceptorok anyagcseréjét biztosító pigmentsejtek (legfelül), a sárga nyíl pedig a fény haladásának irányát jelzi.
Retinális keresztmetszeti séma mutatja a fényingert felfogó (fotoreceptor – felső kék sejtsor) és az információt a retinán belül (bipoláris – középső kék sejtsor), valamint a retinától az agy felé továbbító (dúcsejt – alsó kék sejtsor) idegsejteket. Az információ tér/időbeli mintázatainak kialakításában szintén fontosak az oldalirányú gátló kapcsolatokat biztosító horizontális (felső zöld) és amakrin (alsó zöld) sejtek szerepe. A szürkével jelöltek a fotoreceptorok anyagcseréjét biztosító pigmentsejtek (legfelül), a sárga nyíl pedig a fény haladásának irányát jelzi.A retina idegsejtjeinek hálózata azonban lényegesen több feladatot lát el, mint a fényerő képpontonkénti (pixelenkénti) változásának érzékelése. A felfogott és az idegsejtek számára értelmezhető jelsorrá alakított információt elsődlegesen feldolgozza, analizálja, mielőtt a látórendszer felsőbb idegi központjaiba küldené. A szem és ezzel együtt a retina működése könnyen tanulmányozható, egyedülálló, koponyán kívüli elhelyezkedése miatt. Ugyanez a tulajdonság ugyanakkor hátrány is, mivel a legtöbb látórendszert érintő patológiás elváltozás a kitettsége miatt elsősorban a szemben, a retina működésében következik be.
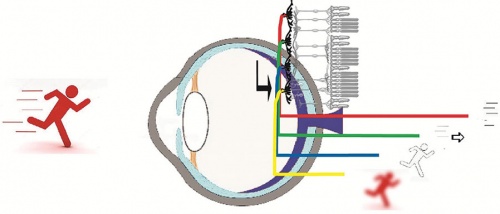 A retina a szem belső falának (lila) mintegy 2/3-át teszi ki. Feladata a látott kép (bal oldali futó alak) érzékelése, annak egyes képi aspektusokra (jobboldalt fentről lefelé – mozgás ténye, mozgás iránya, szín, kontraszt) való felbontása és párhuzamos pályákon történő továbbítása az agy felé. Megjegyzés: a 4 bemutatott képi aspektus nagymértékű leegyszerűsítés, az emlős retinában 30-40 különböző dúcsejttípustól indul ugyanennyi pálya az agy felé.
A retina a szem belső falának (lila) mintegy 2/3-át teszi ki. Feladata a látott kép (bal oldali futó alak) érzékelése, annak egyes képi aspektusokra (jobboldalt fentről lefelé – mozgás ténye, mozgás iránya, szín, kontraszt) való felbontása és párhuzamos pályákon történő továbbítása az agy felé. Megjegyzés: a 4 bemutatott képi aspektus nagymértékű leegyszerűsítés, az emlős retinában 30-40 különböző dúcsejttípustól indul ugyanennyi pálya az agy felé.„A veleszületett és progresszív retinális betegségek (diabéteszes retinopátia, időskori makuláris degeneráció – AMD, retinitis pigmentosa – RP) világszerte emberek millióit akadályozzák mindennapi életvitelük során. Vakságot okoznak, de közvetett módon anyagi és pszichés terhet rónak az egész társadalomra. A WHO 2019-es jelentése szerint világszerte legalább 2,2 milliárd ember látássérült. A látás akár primitívebb formájának visszaadása a vakok, gyengénlátók számára az életminőség drasztikus javulását jelenthetné” – nyilatkozta magazinunknak Völgyi Béla neurobiológus, a Pécsi Tudományegyetem kutatója, az MTA–NAP2 Retinális Elektromos Szinapszisok Kutatócsoport vezetője. Ugyanakkor a vakság legtöbb formájának gyógyítása rövid távon a betegek zöménél nem kivitelezhető. A beteg idegszövet implantátummal történő helyettesítése áthidaló megoldás lehet, amennyiben a retinális idegsejthálózat működése részleteiben ismert – a NAP 2.0 által támogatott Völgyi-labor munkatársai éppen ezeknek az idegsejthálózatoknak a kapcsolatrendszereit térképezik fel.
 A funkcionális kísérletben (elektrofiziológia, Ca++-képalkotás) használt in-vitro egérretina-preparátum (zöld – immunjelölt sejtek, piros – megfestett erek). A kísérletekhez az izolált szövetet kiterítik, és arra alkalmas perfúziós kamrába helyezik.
A funkcionális kísérletben (elektrofiziológia, Ca++-képalkotás) használt in-vitro egérretina-preparátum (zöld – immunjelölt sejtek, piros – megfestett erek). A kísérletekhez az izolált szövetet kiterítik, és arra alkalmas perfúziós kamrába helyezik.A retina fényérzékeny fotoreceptorai által felfogott információt a bipoláris sejtek juttatják a kimeneti dúcsejtekhez, a vertikális információs csatorna működését a horizontális és amakrinsejtek gátló kapcsolatai, valamint a dúcsejt elektromos szinapszisok jelentősen befolyásolják. Ez utóbbi kapcsolatoknak döntő szerepük van abban, hogy a különböző típusú dúcsejtek ugyanennyi képi aspektust (kontraszt, irány, laterális, közeledő- és háttérmozgás stb.) kódolnak, és párhuzamos információs csatornákon küldenek az agy felé. Ismert ugyanis, hogy a retinánkban található 30-40 dúcsejttípus mindegyike egyenként egy-egy olyan lecsupaszított filmet hoz létre, amely a látott kép egyetlen aspektusának változásait rögzíti. A 30-40 különböző dúcsejt ezeket a filmeket ugyanennyi párhuzamos pályán szállítja a felsőbb látóközpontok felé, ahol végül a látott kép (film) látásérzetté alakul.
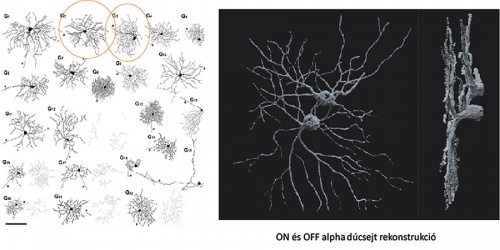 Az ábra bal oldalán a Völgyi-laborban tanulmányozott dúcsejtek közül 22 morfológiailag azonosított és tanulmányozott dúcsejt rajza látható (Völgyi és munkatársai, 2009 nyomán; az aránymértékskála 100 mm). Jobb oldalon egy ON és egy OFF polaritású dúcsejt (a rajzon ezek a típusok be vannak karikázva) számítógépesen rekonstruált képe látható. Megjegyzés: az ON és OFF polaritás arra utal, hogy az adott idegsejt a fény be- vagy kikapcsolásáért felel.
Az ábra bal oldalán a Völgyi-laborban tanulmányozott dúcsejtek közül 22 morfológiailag azonosított és tanulmányozott dúcsejt rajza látható (Völgyi és munkatársai, 2009 nyomán; az aránymértékskála 100 mm). Jobb oldalon egy ON és egy OFF polaritású dúcsejt (a rajzon ezek a típusok be vannak karikázva) számítógépesen rekonstruált képe látható. Megjegyzés: az ON és OFF polaritás arra utal, hogy az adott idegsejt a fény be- vagy kikapcsolásáért felel.Ugyan az elektromos szinapszisok (gap junction) jelenléte közismert minden központi idegrendszeri régióban, jelentőségük mégis jórészt alulbecsült. A Völgyi-labor munkatársai is megfigyeltek munkájuk során több dúcsejt-dúcsejt és dúcsejt-amakrinsejt elektromos szinaptikus kapcsolatot, amelyek a dúcsejtek aktivitásának szinkronizációját, az úgynevezett populációs kód kialakítását végzik. A kutatók azt vizsgálják, hogy a populációs és a klasszikus egysejtkódolási mechanizmus hogyan működik közre, hogy számunkra a látás élményét létrehozzák.
 Bal oldalon a retina felszínén található dúcsejt sejttestek láthatók (zöld), melyek közül egyet a kísérlet során jelölőanyaggal feltöltöttek (piros), lefényképeztek és számítógépesen rekonstruáltak (jobb oldal) a kutatók. Megjegyzés: a zöld GcaMP-Thy1 és a piros A568 a jelölésekhez használt anyagok rövidítéseit, a 63× kép készítéséhez használt lencse nagyítását, az SNT-Fiji trace pedig a rekonstruáláskor alkalmazott programot jelöli.
Bal oldalon a retina felszínén található dúcsejt sejttestek láthatók (zöld), melyek közül egyet a kísérlet során jelölőanyaggal feltöltöttek (piros), lefényképeztek és számítógépesen rekonstruáltak (jobb oldal) a kutatók. Megjegyzés: a zöld GcaMP-Thy1 és a piros A568 a jelölésekhez használt anyagok rövidítéseit, a 63× kép készítéséhez használt lencse nagyítását, az SNT-Fiji trace pedig a rekonstruáláskor alkalmazott programot jelöli. Az elektrofiziológiás vizsgálatok sémája a vizsgált dúcsejtekkel (zöld), az elektromos aktivitást végző üvegelektródák hegyével (fekete) és az elvezetett akcióspotenciál-sorozatokkal.
Az elektrofiziológiás vizsgálatok sémája a vizsgált dúcsejtekkel (zöld), az elektromos aktivitást végző üvegelektródák hegyével (fekete) és az elvezetett akcióspotenciál-sorozatokkal.A közelmúltban a labor munkatársai bebizonyították, hogy a párhuzamos retinális csatornákon haladó információ típusspecifikus eltéréseket mutat a fényválaszok időbeli gyorsaságában és lefutásában. Már egy egyszerű homogén fénystimulus ki- és bekapcsolására is egyes dúcsejtek gyorsan (50-60 milliszekundum), mások relatíve nagy időkéséssel (> 200 milliszekundum) válaszolnak.
 Retinális dúcsejtek fénystimulus (homogén fehér fény – a be- és kikapcsolást a sárga téglalap jelzi) akcióspotenciál-sorozatai (alul az időlépték látható másodpercben megadva). Felül 6 különböző ON polaritású (fekete), alul 6 OFF polaritású sejt (piros) aktivitása látható egymás alatt (a jobb érzékelhetőség kedvéért minden egyes sejt esetén 6 egymást követő fényválasz látható egymás alatt). A Völgyi-labor munkatársai bemutatták, hogy a különböző típusú dúcsejtek a fényre különböző sebességgel/késéssel reagálnak (Tengölics és munkatársai, 2019).
Retinális dúcsejtek fénystimulus (homogén fehér fény – a be- és kikapcsolást a sárga téglalap jelzi) akcióspotenciál-sorozatai (alul az időlépték látható másodpercben megadva). Felül 6 különböző ON polaritású (fekete), alul 6 OFF polaritású sejt (piros) aktivitása látható egymás alatt (a jobb érzékelhetőség kedvéért minden egyes sejt esetén 6 egymást követő fényválasz látható egymás alatt). A Völgyi-labor munkatársai bemutatták, hogy a különböző típusú dúcsejtek a fényre különböző sebességgel/késéssel reagálnak (Tengölics és munkatársai, 2019).A kutatók azt is bizonyították, hogy egy sejttípus esetében az időbeli paraméterek a fényinger típusától (homogén/mintázat, álló/mozgó) és egyéb paramétereitől (fényerő, szín stb.) változatosságot mutatnak. Megfigyelték, hogy a válaszkésések finomhangolásához a retinális pályák aktív részvétele szükséges, különös tekintettel az oldalirányú GABA – a többnyire gátló hatású neurotranszmitter – által közvetített gátló, valamint az elektromos szinapszisok általi serkentő kapcsolatokra.
 Balra egy retinapreparátum felszíne Ca++ látható képalkotási vizsgálat közben (a dúcsejtek sejttesteinek világosságát az indikátor Ca++-kötése okozza; a jelölés erőssége az egyes sejtek aktivitási szintjeire utal, melynek időbeli változása követhető). Jobb oldalon a színkódolt 3 dúcsejt aktivitásának (fényességének) időbeli változása látható.
Balra egy retinapreparátum felszíne Ca++ látható képalkotási vizsgálat közben (a dúcsejtek sejttesteinek világosságát az indikátor Ca++-kötése okozza; a jelölés erőssége az egyes sejtek aktivitási szintjeire utal, melynek időbeli változása követhető). Jobb oldalon a színkódolt 3 dúcsejt aktivitásának (fényességének) időbeli változása látható. A labor munkatársai megfigyelték, hogy a dúcsejtek többsége a fényinger egyes tulajdonságainak változtatásakor különböző időbeli dinamikával (pl. késés) válaszol. A képen egy ON (fekete) és egy OFF (piros) polaritású dúcsejt fényválaszai láthatók egymás alatt. A fény be- és kikapcsolását a sárga téglalap jelzi, a fénystimulus hullámhosszára padig a bal oldalon látható színskála és a számok utalnak (Tengölics és munkatársai 2019 nyomán).
A labor munkatársai megfigyelték, hogy a dúcsejtek többsége a fényinger egyes tulajdonságainak változtatásakor különböző időbeli dinamikával (pl. késés) válaszol. A képen egy ON (fekete) és egy OFF (piros) polaritású dúcsejt fényválaszai láthatók egymás alatt. A fény be- és kikapcsolását a sárga téglalap jelzi, a fénystimulus hullámhosszára padig a bal oldalon látható színskála és a számok utalnak (Tengölics és munkatársai 2019 nyomán).„Azt feltételezzük, hogy ezzel a válaszkésési finomhangolással a látórendszer súlyozza a szállított információ hatásfokát, vagyis azt, hogy az mennyire lesz meghatározó a látásérzetben. Az eredmények egy részét kollaborációs munka keretében egy számítógépes retina algoritmus segítségével is reprodukáltuk, amely előrevetíti az eredmények lehetséges jövőbeni technológiai felhasználását” – összegez Völgyi Béla, akitől megtudtuk, hogy a kutatócsoport a kísérletes munka nagy részét speciálisan erre a célra tenyésztett, genetikailag módosított (GMO) egereken végezte.
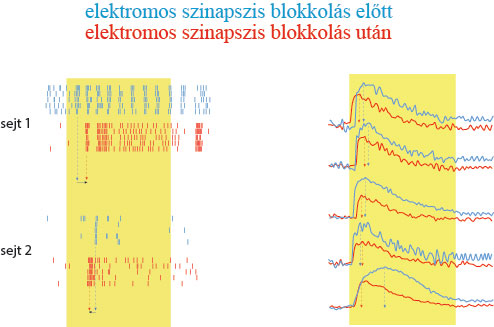 Dúcsejt fényválaszok az elektromos szinapszisok blokkolása előtt (kék) és után (piros). A farmakológiai blokkolásnak a válaszok késésére kifejtett hatása mind az elektrofiziológiai (bal oldal), mind a Ca++-képalkotási kísérletekben (jobb oldal) jól megfigyelhető.
Dúcsejt fényválaszok az elektromos szinapszisok blokkolása előtt (kék) és után (piros). A farmakológiai blokkolásnak a válaszok késésére kifejtett hatása mind az elektrofiziológiai (bal oldal), mind a Ca++-képalkotási kísérletekben (jobb oldal) jól megfigyelhető.Ugyanakkor az emberi retina szövetében is sikerült kimutatni ugyanazokat a dúcsejt elektromos szinaptikus kapcsolatokat, amelyeknek a szerepét az egérretinán tisztázták. Ez utóbbi valószínűsíti azt a tényt, hogy a munkacsoport felfedezései nem az egérretina sajátságai, hanem olyan folyamatokról árulkodnak, amelyek saját látásunkat, képi világunkat is nagyban meghatározzák.
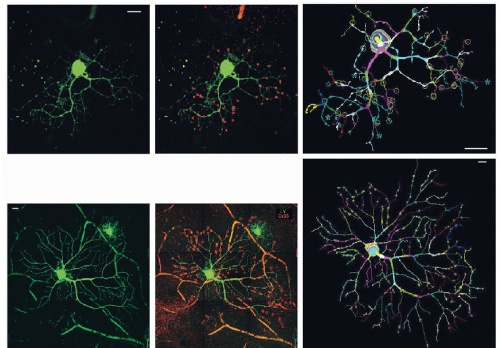 Retinális dúcsejtek az emberi retinában. A jelölőanyaggal megfestett dúcsejtek (zöld – bal oldalon és középen) a kísérletekben megfigyelt egér dúcsejtekkel teljes mértékben hasonlatosak abban, hogy dendritjeiken megfigyelhetők elektromos szinapszisok (apró piros körök a középső, fehér karikák a jobb oldali paneleken). Jobb oldalon a jelölt dúcsejtek rekonstruált képei láthatók.
Retinális dúcsejtek az emberi retinában. A jelölőanyaggal megfestett dúcsejtek (zöld – bal oldalon és középen) a kísérletekben megfigyelt egér dúcsejtekkel teljes mértékben hasonlatosak abban, hogy dendritjeiken megfigyelhetők elektromos szinapszisok (apró piros körök a középső, fehér karikák a jobb oldali paneleken). Jobb oldalon a jelölt dúcsejtek rekonstruált képei láthatók.A retina pontos kódolási mechanizmusainak megfejtése révén a jelenleg használatos retinális implantátumok algoritmusainak tökéletesítésére nyílik majd lehetőség.
A Völgyi-labor eredményei nívós nemzetközi lapokban, mint a PLoS One, Frontiers in Cellular Neuroscience, Brain Structure and Function jelentek és jelennek meg.•