Górcső alatt az asztrociták – a fájdalomcsillapítás a gerincvelőben kezdődik?
 Mészár Zoltán
Mészár ZoltánÖnök a Nemzeti Agykutatási Program keretében a fájdalominformációt feldolgozó gerincvelői hálózat keletkezésével, a rendszer működésével, illetve a szervezet saját fájdalomcsillapító mechanizmusainak megértésével foglalkoznak. Miért a gerincvelő felől közelítik a fájdalominformációt?
– Ha röviden akarok válaszolni, akkor azért különösen izgalmas ebből a megközelítésből a gerincvelő, mert valós fájdalomérzés csak abból az információból lesz, ami a gerincvelőből az agyba eljut. A gerincvelői fájdalomfeldolgozó rendszer a gerincvelő hátsó szarvának felszínes zónájához kötődik, az agyban pedig felrostozódik. Farmakológiai szempontból így kézenfekvő cél, hogy a fájdalmat a gerincvelő fájdalomfeldolgozó hálózaton keresztül igyekezzünk csillapítani. Ehhez azonban előbb meg kell érteni e rendszer működésének számos, ma még nem teljesen világos részletkérdését.
Ha gyerekkorunkban elestünk, és a fájdalom miatt sírva fakadtunk, édesanyánk azzal vigasztalt, hogy a fájdalom mindjárt elmúlik. Ez így is történt. Felnőttként azonban azt tapasztaljuk, hogy vannak olyan fájdalmak, amelyek nem múlnak el gyorsan. Mi lehet ennek az oka?
– Az akut fájdalom jó dolog, hiszen szöveti károsodást jelez, és arra motivál bennünket, hogy szüntessük meg ennek a forrását. Vegyük el a kezünket a forró fazéktól, az éles késtől stb. Létezik azonban olyan, például daganatos betegségeket vagy ízületi gyulladásokat kísérő krónikus fájdalom is, amely nem szüntethető meg ilyen egyszerűen. Arra vagyunk kíváncsiak, hogyan alakul át az akut fájdalom krónikus fájdalommá. A gerincvelőben ugyanis mindkét fajta fájdalom ingerületvezetését ugyanaz a hálózat végzi, vagyis az akut fájdalom krónikusba fordulása a hálózat áthangolódásával, finomhangolásával, a rendszer szenzitizálásával függ össze.
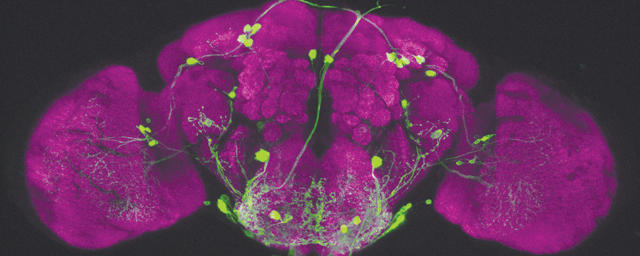
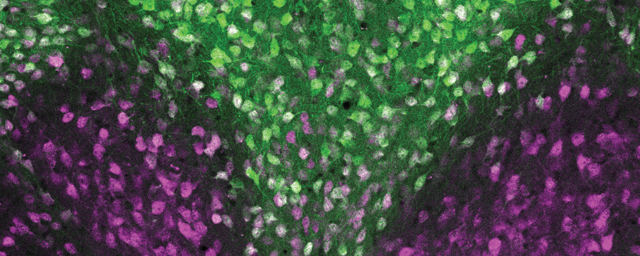
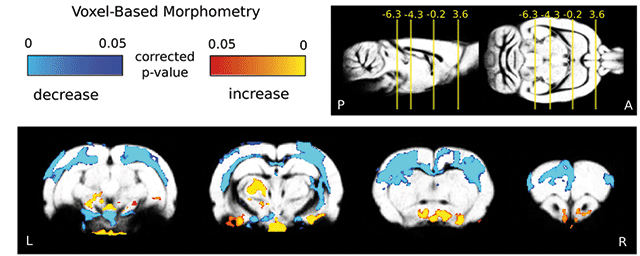
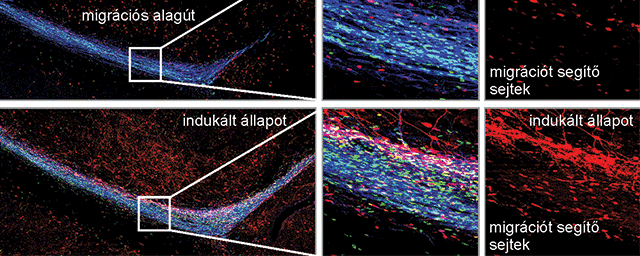
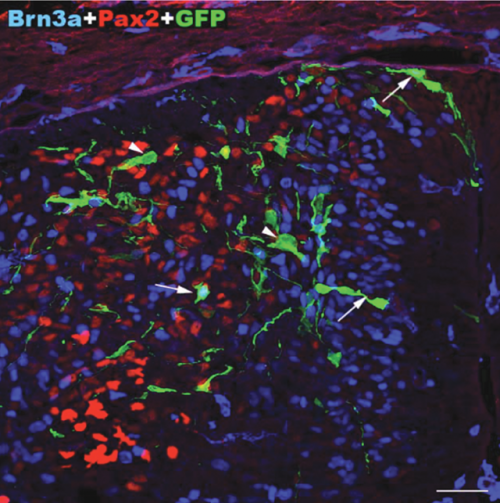 Migráló, éretlen idegsejtek, amelyek a gerincvelő fájdalomfeldolgozó hálózatát építik fel. Zöld: transzgenikus, zöld fluoreszcens fehérjét tartalmazó idegsejtek. Kék és vörös: serkentő és gátló idegsejt fejlődés irányába már elköteleződött sejtek (immunhisztokémia).
Migráló, éretlen idegsejtek, amelyek a gerincvelő fájdalomfeldolgozó hálózatát építik fel. Zöld: transzgenikus, zöld fluoreszcens fehérjét tartalmazó idegsejtek. Kék és vörös: serkentő és gátló idegsejt fejlődés irányába már elköteleződött sejtek (immunhisztokémia).NAP projektjük keretében önök a központi idegrendszer egyik jelentős jutalmazó, fájdalomenyhítő rendszerét, az endokannabinoid rendszert is vizsgálják. Ennek agyi területekhez kötődő működését számos más kutatócsoport tanulmányozta. Önöket milyen megközelítésből érdekli ez a rendszer?
– Azt szeretnénk kideríteni, pontosan mi az endokannabinoid rendszer szerepe a gerincvelői fájdalomfeldolgozásban. Lehetséges ugyanis, hogy fájdalomcsillapító rendszerként működik, de az is elképzelhető, hogy bizonyos körülmények között elősegíti a fájdalommal kapcsolatos információk továbbítását az agy felé, azaz szenzitizálja a gerincvelőt. Azt gondoljuk, hogy a gliasejtek közé tartozó asztrocitáknak kulcsszerepük lehet a krónikus fájdalom kialakulásában.
Legújabb kutatási eredményeik talán arra is választ adhatnak, hogyan történik az, hogy az asztrociták „átállnak az ellenséghez”, és a gerincvelő szenzitizálásán keresztül éppen súlyosbítják a fájdalmat?
– A legfrissebb publikációnkban, amelyet Hegyi Zoltán kollégám jegyez, az asztrociták CB1 receptorainak működését mutatjuk be. A CB1 receptor aktiválására az asztrociták 2-AG-t (2-arachidonil-glicerol), azaz a CB1 receptor egyik természetes ligandumát kezdik felszabadítani. Ám ez vizes közegben magától átalakul egy korábban inaktívnak gondolt vegyületté, 1-AG-vá. Kiderült azonban, hogy az 1-AG nem inaktív, hanem a 2-AG hatásait utánozza, sőt hozzájárul a 2-AG hatásának stabilizálásához. Kóros körülmények között, például gyulladásos folyamat hatására, az asztrociták működése áthangolódik, és egy ciklooxigenáz-2 (COX-2) enzimet kezdenek nagy mennyiségben termelni, ami a 2-AG-t egy olyan vegyületté (prosztaglandinná) alakítja, melynek szerepe a fájdalom kialakulásában jól ismert.
Ön néhány évvel ezelőtt egy speciális génbeviteli módszert kezdett alkalmazni. Mi ennek a lényege?
– A génbeviteli eljárás neve in utero elektroporáció, amelynek segítségével azt vizsgáljuk, hogy ez a fájdalomfeldolgozó hálózat hogyan áll össze. Szerintem azok az idegsejtek, amelyek az embrióban egy időben születnek, hasonló érettséggel rendelkeznek, nagyobb az esélyük arra, hogy közöttük sokkal erősebb kapcsolat legyen, mint azokból az idegsejtekből, amelyek eltérő időpontban születnek. A kutatásainkhoz éppen ezért használjuk ezt a génbeviteli módszert, amellyel a gerincvelői fájdalomfeldolgozásban lévő idegsejteket már születésük pillanatában, embrionális állapotuktól meg tudjuk jelölni, illetve születésüktől fogva tudjuk őket manipulálni.
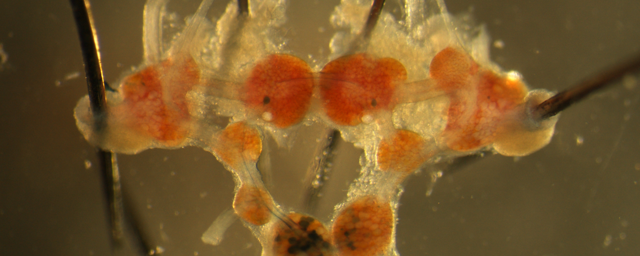
 Orvostanhallgatók – Hadházi Dorottya és Kerti Ádám – a laborban; transzgenikus egér létrehozása in utero elektroporációval.
Orvostanhallgatók – Hadházi Dorottya és Kerti Ádám – a laborban; transzgenikus egér létrehozása in utero elektroporációval.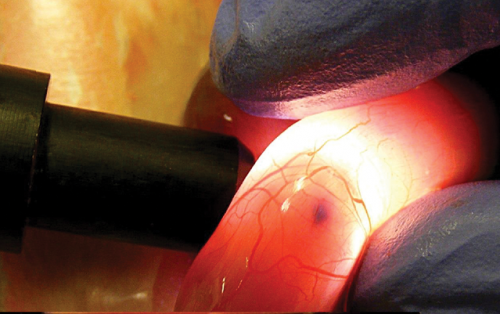 Kékeszöld festékkel láthatóvá tett, transzgént tartalmazó DNS-oldat az egérembrió agykamráiban.
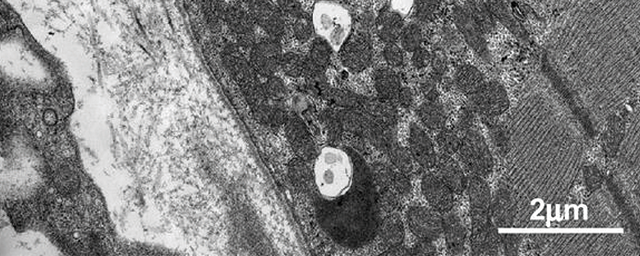
Kékeszöld festékkel láthatóvá tett, transzgént tartalmazó DNS-oldat az egérembrió agykamráiban.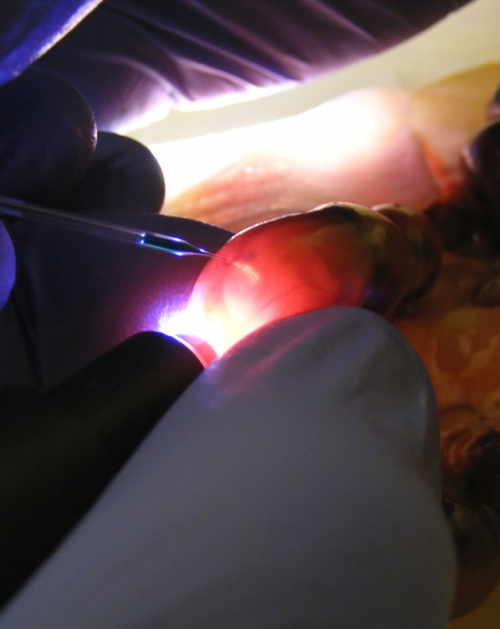 Transzgén mikroinjekciója az anyaméhen belül levő embrionális agy- és gerincvelőbe.
Transzgén mikroinjekciója az anyaméhen belül levő embrionális agy- és gerincvelőbe.Mi a kapcsolatuk a Debreceni Egyetem másik fájdalomkutató csoportjával?
– A Szűcs Péter által vezetett NAP B fájdalomkutató csoporttal annyira szoros az együttműködés, hogy most egy közös pályázaton indulva akarunk továbblépni. Szűcs Péter elektrofiziológiai módszerekkel az idegsejtek elektromos jeleit tudja mérni. Az általam használt transzgenikus technológia a Péter által használt fiziológiai és morfológiai karakterizálási módszerekkel ötvözve jóval részletesebb információt szolgáltat a gerincvelői érzőrendszer működéséről és szerveződési alapjairól.
Mik a legújabb eredményeik?
– A legújabb, még nem publikált közös eredményünk ötvözi az elektroporációs és virális géntechnológiát az elektrofiziológiai és optogenetikai vizsgálómódszerekkel. Olyan egereket hoztunk létre, amelyek egy időben született hátsó szarvi idegsejtjeiben egy bizonyos hullámhosszú fény hatására aktiválódó ioncsatornát kódoló gént hordoznak. Ezzel nagyon speciális idegcsoportot, az úgynevezett kései születésű gerincvelői idegsejteket tudtunk fénnyel aktiválni.
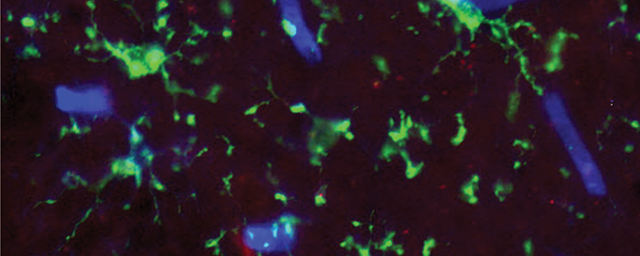
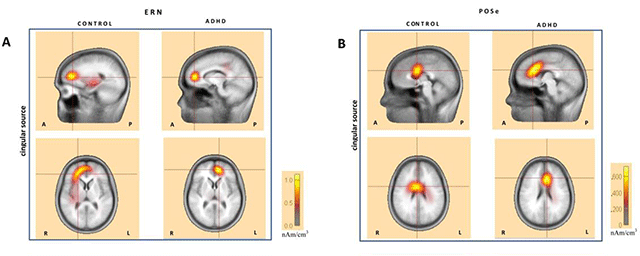
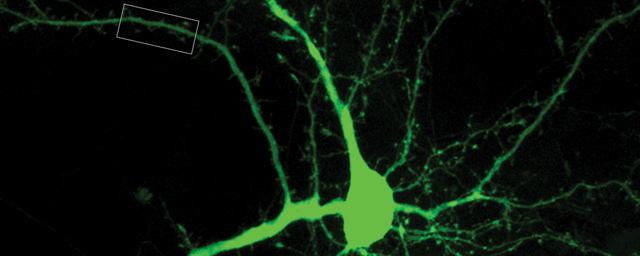
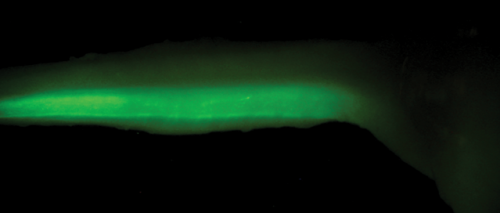 Zöld fluoreszcens fehérjét kifejező, transzgenikus gerincvelői idegsejtek kifejlett állatból (in utero elektroporáció).
Zöld fluoreszcens fehérjét kifejező, transzgenikus gerincvelői idegsejtek kifejlett állatból (in utero elektroporáció).Azt találtuk, hogy ezek az idegsejtek egy másik gerincvelői szegmentumra gyakorolt hatása egyfajta tónusos gátlás. Ez a működés a gerincvelői fájdalomhálózat diszkriminatív jellegére utal.•
2017. augusztus