Agyprogram félidőben, kimagasló eredményekkel
„A Nemzeti Agykutatási Program első szakaszában intézeteket is támogattak, a második szakaszban kizárólag kutatócsoportok pályázhattak. A KOKI nyertes csoportjai közül egyetlen kivétellel valamennyi működött az első kiírás idején” – tájékoztatott Acsády László, a KOKI igazgatóhelyettese. A NAP 2.0 egyébként azért támogatott kutatócsoportokat, mert az élettudományi, ezen belül az idegtudományi kutatások a világon mindenütt ilyen egységekben folynak. Ez az a lépték, ami hatékony. A KOKI-s csoportokban 8-12 kutató dolgozik, ennyi emberrel van napi kapcsolatban a csoportvezető, aki nemcsak a szakmai munkát irányítja, hanem a pénzügyekért is felel. A csoportok közötti szoros szakmai kapcsolatok alapvetőek, hiszen mindig van olyan technika, amit valaki más jobban ismer – például azért, mert rendelkezik a megfelelő eszközzel.
A NAP 2.0 keretében a KOKI-ban folyó kutatások túlnyomó többsége olyan, a társadalom számára igen komoly terhet jelentő, az idegrendszerhez köthető krónikus elváltozások hátterének felderítését tűzi ki célul, melyeket jelenleg alig értünk és/vagy nincs rájuk megfelelő gyógymód. E betegségek rendkívül széles köre a bél-agy tengelytől, a pajzsmirigyhormon-háztartás problémáin és a magzati alkohol szindrómán át a magasabbrendű pszichés elváltozásokig terjed. Utóbbiak között szerepel az autizmus kialakulása, a születéskori oxigénhiány felnőttkori mentális következményei vagy a pánikbetegség idegrendszeri alapjai.
Az intézet egyik fontos kutatási iránya a pajzsmirigyhormon-háztartás titkainak megértése. Az állandóan termelődő pajzsmirigyhormon minden létező sejtünkre hat, alapvetően befolyásolja azok energiaháztartását. A statisztikák szerint világszerte több mint 100 millió embert érint ez a probléma. Habár a pajzsmirigy alulműködése elméletileg hormonpótlással könnyen kezelhető, sajnos ez a kezelés a betegek egy jelentős csoportjánál nem védi ki a hipotireózis minden tünetét. Ezért a pajzsmirigyhormonok szövetspecifikus hatásának, így az agyban kifejtett hatásának feltárása alapvető jelentőségű.
..............................................
A Fekete Csaba és Gereben Balázs által vezetett két intézeti csoport kísérleti egerek génállományát úgy módosította, hogy a pajzsmirigyhormon hatásának változását élő állatokban a szövetek által kibocsátott fény mérésével nyomon lehessen követni. Az általuk előállított THAI egérmodell kiválóan alkalmas a szöveti pajzsmirigyhormon-hatás fiziológiás és patofiziológiás állapotokban bekövetkező változásának megismerésére, a pajzsmirigyhormon jelátvitel befolyásolására fejlesztett molekulák szöveti hatásának tesztelésére, illetve az ipar által előállított kémiai anyagok pajzsmirigyhormon-háztartásra gyakorolt káros hatásainak meghatározására.
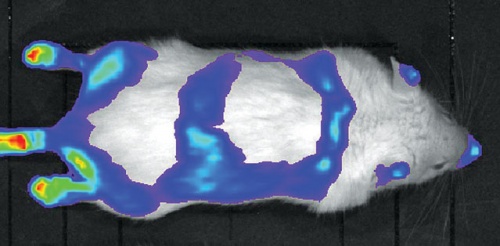 Pajzsmirigyhormon-hatás vizsgálata THAI egérben in vivo imaging alkalmazásával.
Pajzsmirigyhormon-hatás vizsgálata THAI egérben in vivo imaging alkalmazásával.Az egérmodellt már több országban, például az Egyesült Államokban, Németországban és Kínában használják alaptudományi kutatásokhoz. Többéves munkájuk eredményeként az egérmodell idén szabadalmi védelmet kapott Magyarországon, az Európai Unióban és az Egyesült Államokban. Acsády László szerint a két csoport eljárásának köszönhetően derült ki, hogy egy gyakori endokrin kórkép, az alacsony T3 szindróma eltérően hat az egyes szervekben a pajzsmirigyhormon-hatásra. Míg a szindróma bizonyos agyterületeken fokozza a pajzsmirigyhormon-hatást, az agyalapi mirigyben és a bélben pont ellenkezőleg, jelentősen csökkenti e hormonok hatását. Az eredményeknek köszönhetően a fejlesztők optimalizálni tudják a hormonkezeléseket és tesztelni tudják, hogy az újonnan fejlesztett vegyületek miként befolyásolják az egyes szöveteket, szerveket. Ugyanők fedeztek fel egy új szabályozó mechanizmust, melyben egy az agykamra falában elhelyezkedő különleges glia sejttípus kannabinoid receptoron keresztül ható molekula előállításával tudja szabályozni idegsejtek aktivitását és ezáltal a pajzsmirigy működését.
..............................................
Hrabovszky Erik csoportja humán agyszövetekkel dolgozik – ezekkel ellenőrizni tudja, hogy az állatokban megfigyelt jelenségek közül melyek azok, amelyek humán vonalon is tetten érhetők.
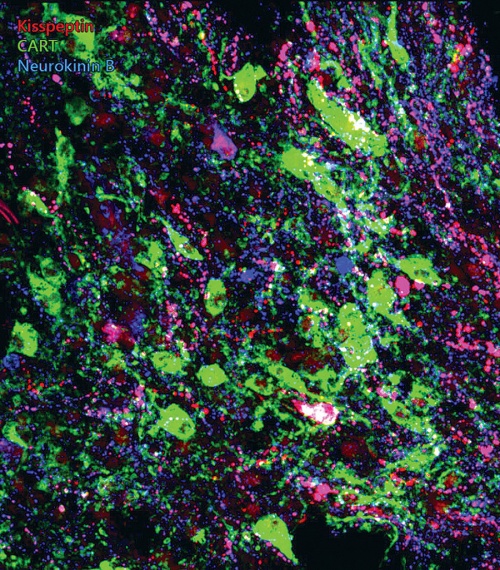 Az immunfluoreszcens módszertannal kimutatott, piros színű ún. kisspeptin idegsejtek kulcsszerepet játszanak a szaporodás agyi szabályozásában, és egy részük két további peptidhormont, neurokinin B-t (kék) és CART-ot (zöld) is termel.
Az immunfluoreszcens módszertannal kimutatott, piros színű ún. kisspeptin idegsejtek kulcsszerepet játszanak a szaporodás agyi szabályozásában, és egy részük két további peptidhormont, neurokinin B-t (kék) és CART-ot (zöld) is termel.A Hrabovszky-csoport az emberi nemi hormonok termelésében szükséges idegsejtek vizsgálatáról közölt alapvető felfedezéseket. Terveik között a pubertáskori problémák és a menopauza körüli változások idegrendszeri hátterének jobb megértése is szerepel.
..............................................
A humán agyszövet a Maglóczky Zsófia által vezetett, a NAP 2.0 által finanszírozott Humán Agyszövet Laboratóriummal való kollaboráció révén áll rendelkezésre a KOKI számos kutatócsoportjának. Ez a biobank egy post mortem agyszövet-laboratórium, amely nemcsak tárolja és rendszerezi a szöveteket, hanem a kutatók kipróbálhatnak új technikákat, amelyekkel a leghatékonyabb módon nyerhető ki a humán agyszövetekből a legtöbb információ. Fontos megérteni, hogy az igen hasznos modellállatként használt egereken felfedezett törvényszerűségek akkor vezethetnek a gyógyászatban is alkalmazható termékekké, ha a feltevéseket emberi agyszöveten is tesztelik.
..............................................
Kovács Krisztina csoportja arra példa, hogy egy szakmai közösség hagyományos kutatási irányát miként egészítette ki új céllal a program. A kutatónő és munkatársai a korticotropin-releasing nevű stresszhormont (CRH) termelő sejtekkel foglalkoztak. A stressznek az agyra gyakorolt hatását nagyon kevesen tanulmányozták, miközben a test egyéb részeire sok figyelem irányult. Kovács Krisztina arra volt kíváncsi, hogy a különböző stresszorok hatására mely CRH-sejtek aktiválódnak az agy különböző területein, és ezek milyen kapcsolatba hozhatók a stressz-indukálta pszichés/magatartási reakciókkal és anyagcsere-betegségekkel. Közben azt is tanulmányozta, hogy a stressz miként hat a bélműködésre! A belekben milliárd számra élnek bélbaktériumok – ezek állítják elő a táplálékból a szervezetünk számára felszívható formájú anyagokat. A bél mikrobiom hihetetlenül forró kutatási terület, hiszen a mikrobiomot szinte az összes betegséggel kapcsolatba hozták. Nemcsak a tápanyagcsere, hanem gyulladásos, keringési, légzőszervi és pszichés betegségekben is szerepet játszik a mikrobiom sérülése. Úgy tűnik, a bélbaktériumoknak nemcsak az a szerepük, hogy alkotóelemeire bontsák a táplálékot, hanem az erekkel és idegsejtekkel sűrűn behálózott bélrendszeren keresztül az agyunkkal is kommunikálnak.
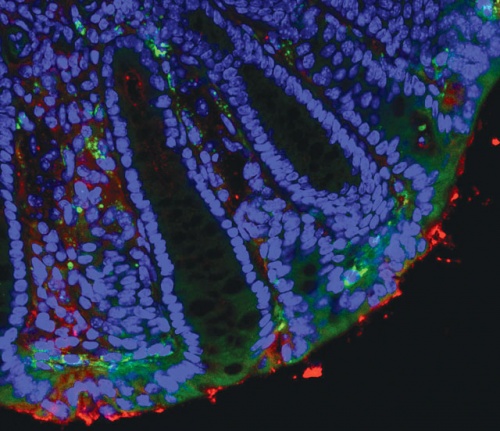 Az egér vastagbelének mikroszkópos metszetén zölddel jelzettek a módosított bélbaktériumok által bejuttatott, zöld fluoreszcens festéket kifejező képletek. (Ferenczi Sz., Dóra D. és Kovács K.)
Az egér vastagbelének mikroszkópos metszetén zölddel jelzettek a módosított bélbaktériumok által bejuttatott, zöld fluoreszcens festéket kifejező képletek. (Ferenczi Sz., Dóra D. és Kovács K.)Ebben a témakörben a tavalyi év egyik átütő felfedezése volt, hogy a Parkinson-kór kialakulásában meghatározó lehet a mikrobiom rossz működése. Ez a betegség nem más, mint rosszul feldolgozott fehérje felhalmozódása az idegsejtek körül, ami egy idő után gyulladást vált ki – ez vezet a dopaminsejtek pusztulásához a középagyban. Úgy tűnik, hogy a bélben keletkeznek a rossz szerkezetű fehérjemagvacskák, amelyek eljuthatnak az agyba, s szerepet játszanak a betegség elindításában. Kovács Krisztináék kutatásaik során rossz fehérjét termelő bélbaktériumot azonosítottak. Emellett olyan, szabadalommal védett módszert dolgoztak ki, amellyel a rossz bélbaktériumoktól megszabadulhatunk. Acsády László szerint elképzelhető, hogy ez a felfedezés rövid időn belül megváltoztatja bizonyos betegségek kezelését, gyógyítását.
..............................................
Sperlágh Beáta és Mikics Éva az életünk korai szakaszában bennünket ért negatív hatások következményeit kutatják. Régóta tudott, hogy a születés körüli időben, azaz perinatális korban a magzatot, illetve újszülöttet az anya felől érő negatív hatás hajlamosíthat az autizmus kialakulására. (Évtizedek óta nincs arra válasz, hogyan alakul ki az autizmus, öröklött vagy szerzett betegségről van-e szó? A hatás mechanizmusa sem ismert.) Sperlágh Beáta és csoportja olyan, az anyai immunaktivációhoz köthető mechanizmust azonosított, amelyen keresztül feltehetően az anyai hatás elviheti a magzat idegrendszerét olyan fejlődési irányba, ami előidézheti a betegséget. A kutatónő által azonosított, az idegsejtek felszínén található jelátvivő molekula gátlásával sikerült megakadályozni egerekben a kedvezőtlen viselkedésjegyek kialakulását. További kísérletekkel ez a folyamat mélységeiben feltárható, és esetleg gyógyszeres beavatkozás alapját teremtheti meg.
Korábban kimutatták, hogy az életünk korai szakaszában bennünket ért legkülönbözőbb stresszhatások „visszaköszönnek” felnőtt életünkben, sokszor olyan formában, hogy túlzott agresszióval reagálunk bizonyos helyzetekre. Az nem igaz, hogy minden, gyerekkorban bántalmazott egyén felnőttkorában agresszív lesz, de a fordítottja nagyon nagy százalékban igaz: szinte minden felnőtt bántalmazó esetében kimutatható gyerekkori bántalmazás vagy súlyos elhanyagolás. De vajon mi az a mechanizmus, amely a gyerekkorban elszenvedett élményt felnőttkori agresszióvá alakítja?
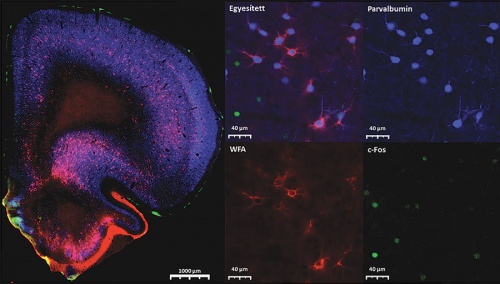 A prefrontális kéreg működésének fontos szabályozói, a parvalbumintartalmú gátló idegsejtek megváltozott aktivitást mutatnak a gyermekkori elhanyagolás következtében kialakuló túlzott agresszió során. A konfokális mikroszkópiával készült képeken kék szín jelöli a parvalbumintartalmú idegsejteket, zöld szín a konfliktushelyzet során aktiválódó idegsejteket és piros szín a gátló idegsejtek működését befolyásoló sejt körüli hálót képző molekulákat.
A prefrontális kéreg működésének fontos szabályozói, a parvalbumintartalmú gátló idegsejtek megváltozott aktivitást mutatnak a gyermekkori elhanyagolás következtében kialakuló túlzott agresszió során. A konfokális mikroszkópiával készült képeken kék szín jelöli a parvalbumintartalmú idegsejteket, zöld szín a konfliktushelyzet során aktiválódó idegsejteket és piros szín a gátló idegsejtek működését befolyásoló sejt körüli hálót képző molekulákat.Mikics Éváék – csoportjuk a NAP 2.0 programnak köszönhetően jött létre – viselkedésszintű megközelítést alkalmaznak, rágcsálók bevonásával. Amikor fiatal rágcsálók egymás közti szociális kapcsolatát megakadályozták – ezzel modellezve a gyermekkori elhanyagolást –, azok felnőttkorukban konfliktushelyzetbe kerülve agresszíven támadtak, emellett olyan helyeken harapták a másik állatot, ami elvileg „tiltott zónának” számít a rágcsálóknál. (Ha két állat harcol egymással, az esetek döntő többségében a küzdelem rituális, a gyengébb nem szenved komoly sérülést, mert a sérülékeny, sebezhető pontok támadása evolúciósan tiltott.) A bántalmazott rágcsálók azonban nem figyelnek a tiltott zónákra, és úgy tűnik, hogy ennek oka a szociális viselkedés legfőbb szabályozójának, az agyi prefrontális kéregnek a megváltozott hálózati működésében keresendő.
Mikics Éva másik kutatási iránya az oxigénhiányos állapotban megszülető csecsemők felnőttkori viselkedésének elemzése. Gyermekgyógyászokkal és pszichiáterekkel összefogva próbálják megállapítani, hogy az oxigénhiányos állapot hatására kialakuló későbbi tanulási nehézségeknek és pszichés zavaroknak a hátterében idegrendszeri mechanizmusok állhatnak. A cél annak kiderítése, hogy milyen gyógyszerrel előzhetnék meg a születés körüli trauma felnőttkori következményeinek kialakulását.
..............................................
A Katona István vezette csoport legújabb szenzációja a Nature Communicationsben jelent meg. Ők az idegsejtek fejlődésében egy teljesen új, eddig nem ismert mechanizmust fedeztek fel, ami segít megérteni az agy normális fejlődését, emellett számos agyi fejlődési rendellenesség mechanizmusára adhat választ. Sejtjeink többsége ugyanis – molekuláris kapcsokkal összekötve – a számára ideális szöveti mikrokörnyezetben működik. Normális esetben mindig több sejt születik, mint amennyi túlél. A hibás vagy felesleges sejt kapcsolatait elveszíti, kiszakad a szöveti mikrokörnyezetéből, a szakemberek kifejezésével „hontalanná” válik, és akkor beindul a programozott sejthalál, mely eltünteti a felesleges sejtet. A folyamatosan osztódó őssejtek esetében a hontalanná válás különösen fontos. Az is jól ismert tény, hogy a daganatos áttétek képződése során a tumorsejt is „meg tud szökni”, és esetében pontosan az a probléma, hogy nem indul meg a programozott sejthalál. Nyitva maradt azonban a kérdés, hogy normális esetben mi a mechanizmusa a „hontalanná” válásnak, és mi történik, ha ez a rendszer túlzottan aktív lesz.
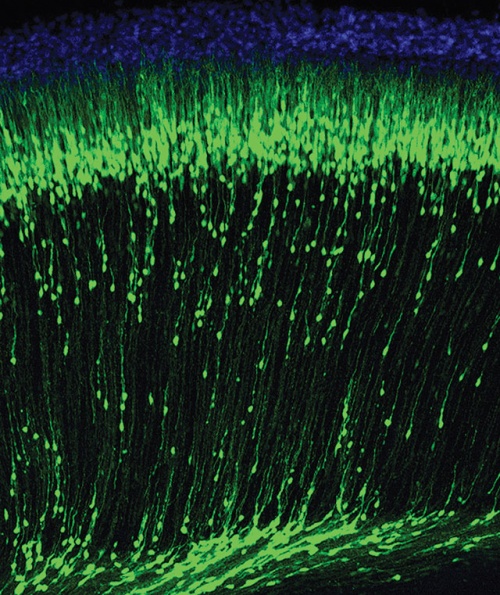 Vándorló idegsejtek egy egér fejlődő agykérgében.
Vándorló idegsejtek egy egér fejlődő agykérgében.Egérmodell segítségével felfedezték, hogy a jelenség kulcsszereplője egy eddig ismeretlen enzim, mely nélkülözhetetlen a szükségtelen sejtek eltüntetéséhez. Azt is feltárták, hogy az enzim túlaktiválódik az anyai alkoholfogyasztás esetén, és ez sejthalálhoz vezet az embriók agyában. Eredményük ezért a magzati alkohol szindrómával együtt járó csökkent értelmi képesség jelenségének megértéséhez is nagyban hozzájárul. Acsády László szerint elképzelhető, hogy ennek a felismerésnek nemcsak az idegsejtek szaporodásában, pontos számuk meghatározásában lesz jelentősége, hanem a daganatos betegségek kezelésében is szerepe lehet.
..............................................
Az egyik legelterjedtebb pszichés betegség a pánikbetegség, a szorongás. Gyakran olyan dologtól félünk, aggódunk, amitől nem kellene. Ennek oka, hogy az agyunk tévesen asszociálja a körülöttünk lévő dolgokat, helyzeteket a félelemmel. Ha történetesen megharap minket egy nagy kutya, kialakulhat bennünk a kutyákkal szembeni félelem, de az kóros, ha valaki egy öleb láttán sem mer kimozdulni a lakásából. Ezért fontos a félelmi agyközpont kutatása – az amigdala nevű agyterület igen sokféle serkentő és gátló sejttípusból áll. Hájos Norbert csoportja félelmi memórianyomok kialakulását kutatja a félelmi agyközpontban. A csoport az amigdala régió különböző sejtjeit egyenként tanulmányozza a világon egyre népszerűbb technikával: ez az optogenetika.
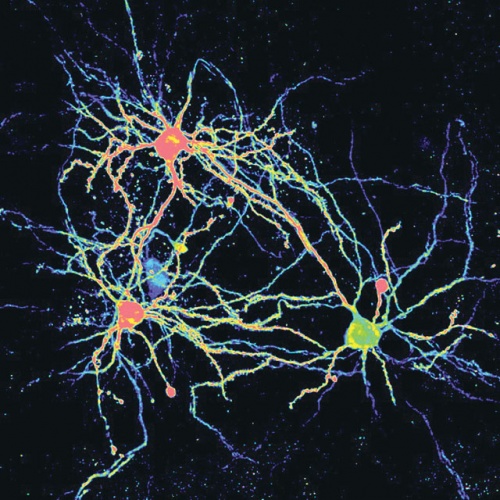 Az idegsejtek hálózata az agy félelmi központjában. Az amigdalában található idegsejtek szabályozzák a félelmimemória-folyamatokat.
Az idegsejtek hálózata az agy félelmi központjában. Az amigdalában található idegsejtek szabályozzák a félelmimemória-folyamatokat.Az eljárás lényege, hogy fényérzékeny molekulát fejeztetnek ki a számukra fontos sejttípussal, majd specifikusan serkenthetik, illetve gátolhatják ezeket a sejteket adott viselkedési szituációban. Így egerek agyába ültetett optikai szál segítségével szabályozni tudják az egyes idegsejtek működését. Sejttípusról sejttípusra megállapítható, hogy melyik működik normálisan és melyik kórosan a beteges félelem kialakulásakor. Ha kiderül, hogy melyik mutat ilyen reakciót, tudjuk, hogy melyik sejttípus gátlásával előzhető meg a félelem kialakulása. Ha ismert a sejttípus, olyan hatóanyagot kell előállítani, amely kizárólag erre hat.
..............................................
Nusser Zoltán Európa legrangosabb egyéni kutatói pályázatát, az Európai Kutatási Tanács (European Research Council; ERC) pályázatát másodszor nyerte el – erre a duplázásra Európában még a legkiválóbbak közül is kevesen képesek. A sikeres pályázathoz rendkívül jó alapot biztosított a NAP 2.0 pályázat. Ő alapvetően új módszert fejlesztett ki az idegsejtek közötti kapcsolatok diverzitásának meghatározására. Az idegsejtek a szinapszisokon keresztül kapcsolódnak, amit rengeteg vegyület befolyásol. (Egy szinapszis működéséhez nagyjából 1000 fehérjére van szükség, és ebből úgy 900 strukturális fehérje.) Vajon ezeken a sejteken minden molekulából ugyanannyi található? Nusser Zoltán kutatásai alapján arra a következtetésre jutott, hogy ebből a szempontból minden sejt más. Az idegsejtek kommunikációját befolyásoló fehérjék mennyisége óriási határok között változhat – erről a változatosságról eddig nem is álmodtunk. A Nusser Zoltán által kifejlesztett módszer rendkívül precízen, kvantitatívan megmondja a jelen lévő fehérjék mennyiségét. Ez felettébb fontos információ, hiszen a gyógyszereink ezekre a fehérjékre hatnak.
..............................................
Végül a NAP 2.0 egyik legnagyobb sikertörténete a negatív tapasztalatok feldolgozásában kulcsszerepet játszó sejtcsoportok felfedezése, mely Nyíri Gábor és Freund Tamás munkacsoportjának köszönhető. Eredményeik a világ egyik legjelentősebb szakfolyóiratában, a Science-ben jelentek meg – egy éven belül kétszer. Ehhez tudnunk kell, hogy ilyen bravúrra a világ legnívósabb egyetemein és kutatóintézeteiben is csak elvétve van példa.
 Az idegsejtek hálózata az agy félelmi központjában. Az amigdalában található idegsejtek szabályozzák a félelmimemória-folyamatokat.
Az idegsejtek hálózata az agy félelmi központjában. Az amigdalában található idegsejtek szabályozzák a félelmimemória-folyamatokat.A két Science-cikket hozó felfedezés részesei különféle molekuláris jelölési módszerekkel követték, hogy az egerek agyában mely idegsejtek nyúlványai (axonjai) közvetítik a negatív tapasztalatok információit az agyi feldolgozás során. A nyomok az agytörzs median raphe régió (MRR) nevű területére vezettek, ezen belül is egy korábban még nem ismert serkentő sejtpopulációhoz, mely egy bizonyos fehérjét (vezikuláris glutamát transzporter 2, vGluT2) tartalmaz. Megfejtették, hogy az egerek agyában milyen más sejtpopulációkkal kapcsolódik ez a különleges idegsejt. Azt is felismerték, hogy milyen folyamatok szabályozásában lehet szerepe: optogenetikai módszerekkel igazolták, hogy a sejtek serkentését a kísérleti állatok rossz, elkerülendő élményként élték meg. Ha gátolják a működést, akkor az egerek negatív érzései csökkennek. Ezek az eredmények új, célzott gyógymódok kifejlesztéséhez nyithatnak utat a szorongás kezelésében.
A fentiekből is kitűnik, hogy a NAP 2.0 pályázatnak köszönhetően rendkívüli eredményeket értek el a KOKI kutatócsoportjai. A nyertes csoportok dinamikus fejlődésen mentek keresztül, új technikákat honosítottak meg, rangos szaklapokban jelentek meg kutatási eredményeik. Acsády László szerint tehát követendő példa ez a pályázati rendszer. A NAP 2.0 kiemelkedő jelentőségét az akadémikus abban látja, hogy ezek a kutatócsoportok lehetőséget kaptak arra, hogy merjenek újat gondolni, új módszereket kipróbálni, új kutatási programokat indítani. A csoportok világszinten is az élvonalba tartozó olyan módszereket, metodikákat alkalmaznak, amilyeneket három-négy éve még nem használtak. Ez a finanszírozási modell tehát az eredmények szerint bevált. A NAP 2.0 abban is segített, hogy más pályázatokon sikerrel szerepeljenek a csoportvezetők. Az ERC legtöbb magyar nyertese a KOKI-ban dolgozik, valamennyien a NAP-programok kedvezményezettjei voltak, illetve jelenleg is azok. Érdemes megjegyezni, hogy ezeken az ERC-pályázatokon keresztül az országba áramló pályázati pénz összemérhető nemcsak a KOKI-s csoportoknak jutott NAP 2.0 támogatással, hanem a teljes NAP 2.0 költségvetésével (6,5 milliárd forint).
Acsády László szerint a csoportok konkrét kutatási eredményei mellett hasonló jelentőségű az utánpótlás-nevelés. A kutatócsoportokban dolgozó fiatal kutatók számos PhD-dolgozatot írtak és Tudományos Diákköri versenyt nyertek. Ha a tudományos sikerek versenyképes fizetéssel és kiszámítható jövőképpel társulnak, Acsády László véleménye szerint nem lesz gond az utánpótlással.
A 2012-ben elkezdett és 2017-ben meghosszabbított program tehát igazolta jogosultságát. A tervezhető jövő érdekében logikusan merül fel az érintettekben, hogy lehet-e folytatás, hiszen egy év múlva lejár a támogatás. „Ez a döntéshozóktól függ, de az eredmények alapján a NAP-pénzek nagyon jó helyre kerültek. Mindannyian reméljük, hogy lesz NAP 3.0, ennek értelméről a döntéshozókat is szeretnénk meggyőzni, hiszen az eddigi eredmények közül többet a gyógyszerkutatásban használni lehet és kell” – fogalmazott Acsády László, a KOKI igazgatóhelyettese.•