A legújabb NAP-os eredmények a TTK-ban
Az egyik Nature Neuroscience-cikk vezető szerzője Mátyás Ferenc, a TTK Hálózat és Viselkedés Neurobiológia NAP Kutatócsoport vezetője, a Science-cikk egyik vezető szerzője Hillier Dániel, a TTK Összehasonlító Pszichofiziológiai NAP Kutatócsoportjának tudományos munkatársa, a 2020-as Lendület pályázat egyik nyertese. A további Nature Neuroscience- és Nature Medicine-cikkek társszerzői Fiáth Richárd és Nánási Tibor tudományos munkatársak, akik szintén a TTK Összehasonlító Pszichofiziológiai NAP Kutatócsoportjának tagjai.
A talamusznak a laterális amigdalára irányuló asszociatív és plasztikus hatása irányítja a félelmi viselkedést
Az állandóan változó környezethez való alkalmazkodásnak elengedhetetlen feltétele a korábbi tapasztalatok használata. Az ehhez szükséges kellemes és kellemetlen emléknyomok, az úgynevezett társított tanulás során keletkeznek és rögzülnek az agyban. Ennek színteréül szolgál az amigdala nevű agyterület, ahol a feltételes (hang, kép, szag) és a feltétlen inger (fájdalom, étel, jutalom) összekapcsolása, vagyis a társítás történik. Legalábbis eddig ezt gondoltuk. A Mátyás Ferenc vezető szerzőségével megjelent tanulmányban kimutatták, hogy ez az elképzelés nem pontos: a társítás már az ingerfeldolgozás korábbi szakaszában bekövetkezhet az amigdalát beidegző talamikus sejtek szintjén. Egyes talamikus sejtek képesek összekapcsolni a különböző agytörzsi bemenetek által szállított feltételes és feltétlen információkat, és azokat már mint társított jelet továbbítják az amigdala felé. Ez a felfedezés merőben megváltoztathatja az asszociációs tanulásról kialakított képet, valamint az amigdala funkciójáról kialakított elképzeléseinket.
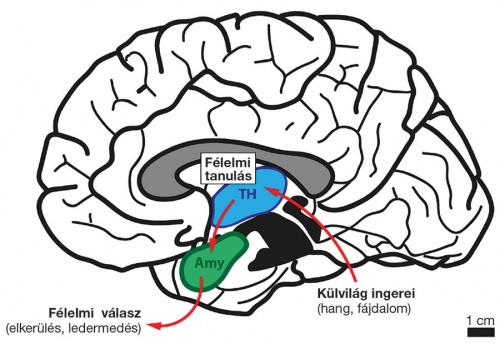 A külvilági ingerek társítása (a tanulás) már a talamuszban (TH, kék) megtörténik, mely az amigdalán (Amy, zöld) keresztül képes befolyásolni a viselkedési reakciókat (például egy veszélyes élethelyzetben). Hivatkozás: Barsy et al. „Associative and plastic thalamic signaling to the lateral amygdala controls fear behavior” (2020) Nature Neuroscience. 23: 625–637. doi: 10.1038/s41593-020-0620-z
A külvilági ingerek társítása (a tanulás) már a talamuszban (TH, kék) megtörténik, mely az amigdalán (Amy, zöld) keresztül képes befolyásolni a viselkedési reakciókat (például egy veszélyes élethelyzetben). Hivatkozás: Barsy et al. „Associative and plastic thalamic signaling to the lateral amygdala controls fear behavior” (2020) Nature Neuroscience. 23: 625–637. doi: 10.1038/s41593-020-0620-zA kutatócsoport önálló eredményeit a világ vezető idegtudományi folyóirata, a Nature Neuroscience közölte idén áprilisban. A jövőben számos kérdés szorul tisztázásra: vajon a talamusz mindenféle jelek társítására képes; csak a talamusz képes a társításra; mi az amigdala pontos funkciója? Mátyás Ferenc és kollégái ezekre a kérdésekre keresik a válaszokat.
A fényérzékenység helyreállítása hangolható közeli infravörös érzékelőkkel
Világszerte sok millió embert érintenek a retina degeneratív megbetegedései, melyek közös vonása, hogy a retinán még fényérzékeny, illetve már megvakult területek több éven át egymás mellett működnek. A terápiás megközelítésünk lényege, hogy a fényérzékelésre már nem képes, de még élő sejttesttel rendelkező fotoreceptorokba egy génterápiás vírussal egy másik fényérzékeny fehérje kódját juttatjuk be. Ilyen fehérje például az algákban 2003-ban felfedezett és azóta széles körben használt channelrhodopsin, melyet erős kék fénnyel megvilágítva a beteg ismét képessé válik fény érzékelésére. Az emberen alkalmazható terápiás megközelítés másik fontos eleme az úgynevezett bionikus szemüveg, amely egy kamera képét alakítja olyan fénymintázattá, amely hatékonyan képes az új fehérjét kifejező fotoreceptorokat gerjeszteni. Bionikus szemüveget a többi között a Pázmány Péter Katolikus Egyetem Információs Technológiai és Bionikai Karán (PPKE ITK) is fejlesztenek.
Az erős kék fénnyel működő terápia hátulütője, hogy a még természetes módon látó fotoreceptorokat telítésbe viszi, elvakítja. A természetben léteznek fajok, melyek képesek az emberi szem számára láthatatlan infravörös sugárzás, azaz hő érzékelésére (kígyók, denevérek). A természet megoldását ellesve hőérzékeny fehérjét termeltettünk a fotoreceptorokkal, de a hatékony látásvisszaállításhoz szükséges volt, hogy arany nanorudacskákat kapcsoljunk a fotoreceptorokba bevitt hőre érzékeny fehérjékhez, így elértük, hogy biztonságos és hatékony módon lehessen infravörös fénnyel újra látóvá tenni a fotoreceptorokat.
 Háromkomponensű génterápia a degeneratív vakság gyógyítására: a szembe juttatott injekció a retina fotoreceptorain kifejezett hőérzékeny csatornákhoz (zöld) antitestek által (lila) köti az antenna szerepét játszó arany nanorudacskákat. Hivatkozás: Nelidova et al. „Restoring light sensitivity using tunable near-infrared sensors” (2020) Science. 368 (6495): 1108–1113. doi: 10.1126/science.aaz5887
Háromkomponensű génterápia a degeneratív vakság gyógyítására: a szembe juttatott injekció a retina fotoreceptorain kifejezett hőérzékeny csatornákhoz (zöld) antitestek által (lila) köti az antenna szerepét játszó arany nanorudacskákat. Hivatkozás: Nelidova et al. „Restoring light sensitivity using tunable near-infrared sensors” (2020) Science. 368 (6495): 1108–1113. doi: 10.1126/science.aaz5887A Hillier Dániel (TTK–PPKE ITK) társ-levelezőszerzőségével megjelent Science-cikkben publikált terápiától azt reméljük, hogy a több millió még nem teljesen vak, de már komoly látásveszteséggel küzdő beteg számára visszaadjuk az arcok felismerésének, valamint az olvasás és a környezetben való tájékozódás képességét.
Agykérgi sejtek transzkriptomika-alapú csoportosítása
Az agyszövet, ahogyan általában a többi biológiai szövet és szerv is, többféle sejttípusból épül fel. A különféle agyi funkciók (pl. észlelés, memória, figyelem) mögött meghúzódó idegi folyamatok megértéséhez az egyik fontos lépcső az agykéregben (mely az emlősök agyának legnagyobb része) megtalálható nagyszámú sejttípus elkülönítése, majd jellemzőik és szerepük alapos megismerése. Idegsejtek esetén eddig a fő irányvonal azok alaktani (morfológiai), elektromos (elektrofiziológiai), illetve molekuláris tulajdonságaik alapján történő elkülönítés volt. Azonban, főként a vizsgált sejtek alacsony száma, valamint az inkább kvalitatív jellegű vizsgálatok miatt, az évek során nem alakult ki egy egységes rendszertan, továbbá az agykéregben megtalálható sejttípusok számát tekintve sincs egyetértés. Egy kvantitatív, genetikai alapú módszer, az egysejt-transzkriptomika segítségével most lehetőségünk nyílik szisztematikus, nagy áteresztőképességű mérésekre, melyek közelebb vihetnek egy egységes és teljes agyi sejt taxonómia kialakításához.
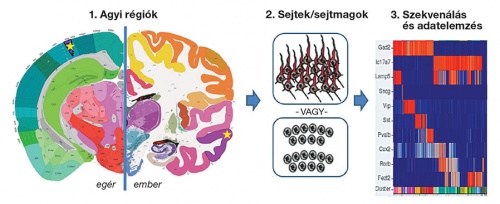 Az idegsejtek transzkriptomika-alapú csoportosításának főbb lépései. Forrás: Allen Institute (portal.brain-map .org/atlases-and-data/rnaseq) Hivatkozás: Yuste et al. „A community-based transcriptomics classification and nomenclature of neocortical cell types” (2020) Nature Neuroscience. doi: 10.1038/s41593-020-0685-8
Az idegsejtek transzkriptomika-alapú csoportosításának főbb lépései. Forrás: Allen Institute (portal.brain-map .org/atlases-and-data/rnaseq) Hivatkozás: Yuste et al. „A community-based transcriptomics classification and nomenclature of neocortical cell types” (2020) Nature Neuroscience. doi: 10.1038/s41593-020-0685-8A Nature Neuroscience nevű tudományos szaklapban publikált tanulmányunk, melynek Fiáth Richárd az egyik társszerzője, az agykéregre fókuszáltan ezt a technológiát járja körül, beleértve a módszerrel a közelmúltban elért eredményeket. Az egysejt RNS-szekvenálás, mellyel több ezer gén kifejeződési mintázatait vagyunk képesek mérni nagyszámú sejtben, nemcsak a különböző agykérgi területeken található sejttípusok összevetésére alkalmas, hanem akár különböző fajok vagy egyedfejlődési szakaszok közötti összehasonlításra is. A közlemény bemutatja továbbá, hogy milyen új szemléletre és módszerekre lesz szükség az újfajta adatok feldolgozásához, valamint egy egységes és szabványosított agykérgi sejtatlasz kialakításához és fenntartásához.
Az emberi plazma proteom profiljának hullámzó változásai az életen át
„Egy csepp a zsarnok asszony arcára fröccsent; Erzsébet letörölte, és úgy ítélte meg, hogy bőre még fehérebbé, finomabbá, ragyogóbbá vált, mint annak előtte. Megtalálta tehát a bűbájossággal olyan régóta, olyan nagyon keresett varázsszerét a megfiatalításnak: a szűz leányok véréből készített fürdő eltünteti az öregedés romboló nyomait…” – Mednyánszky Alajos Báthory Erzsébetről
Vér – az ősi hagyományban a vitae, az életerő hordozója. Ugyanakkor az oxigén és az anyagcseretermékek országútja, mely távoli szerveket kapcsol funkcionális egységbe. Híreket is szállít – összefonódik az immunrendszerrel, sejtjeink jelátvivő molekulákat adnak le és vesznek fel a keringő kötőszövetből. Vajon tényleg van kapcsolat a vér állapota és a fiatalság között?
A kaliforniai Stanford Egyetemen évtizedek óta folynak kutatások az öregedés és a regeneráció témakörében. Az egyik legújabb, Nánási Tibor társszerzőségével megjelent tanulmányban a kutatók 373 olyan kulcsfontosságú fehérjét azonosítottak, melyek vérplazmaszintjéből a vizsgált alanyok életkora nagy pontossággal kikövetkeztethető. Azonban ennél fontosabb megállapítást is tettek: felfedezték, hogy az öregedés maga, melyet eddig homogénnek és folyamatosnak gondoltunk, valójában viszonylag stabil állapotok és gyors fázisátmenetek sorozatából áll.
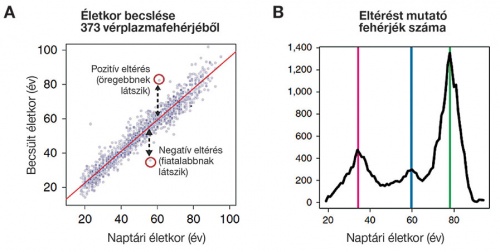 A – az alanyok életkora pontosan megbecsülhető 373 kulcsfontosságú plazmafehérje alapján, melyeket gépi tanulásos módszerekkel azonosítottunk. Az eltérések összefüggenek az alanyok mentális és fizikai állapotával, számos klinikai teszt alapján késleltetett vagy éppen felgyorsult öregedést tükröznek. B – az új típusú analízis konkrét életkortartományokhoz köthető, fázisátmenet-szerű változásokra is érzékeny. Összeszámolva az így detektált eltéréseket, kiderül, hogy a vérplazma korfüggő átrendeződése hullámokban jelentkezik, határozott csúcsokat képezve a 34., a 60. és a 78. életéveknél. Hivatkozás: Lehallier et al. „Undulating changes in human plasma proteome profiles across the lifespan” (2019) Nature Medicine. 25: 1843–1850. doi: 10.1038/s41591-019-0673-2
A – az alanyok életkora pontosan megbecsülhető 373 kulcsfontosságú plazmafehérje alapján, melyeket gépi tanulásos módszerekkel azonosítottunk. Az eltérések összefüggenek az alanyok mentális és fizikai állapotával, számos klinikai teszt alapján késleltetett vagy éppen felgyorsult öregedést tükröznek. B – az új típusú analízis konkrét életkortartományokhoz köthető, fázisátmenet-szerű változásokra is érzékeny. Összeszámolva az így detektált eltéréseket, kiderül, hogy a vérplazma korfüggő átrendeződése hullámokban jelentkezik, határozott csúcsokat képezve a 34., a 60. és a 78. életéveknél. Hivatkozás: Lehallier et al. „Undulating changes in human plasma proteome profiles across the lifespan” (2019) Nature Medicine. 25: 1843–1850. doi: 10.1038/s41591-019-0673-2Az öregedéskutatás egyáltalán nem öncélú. Túlzás nélkül állíthatjuk, hogy éppen a legnagyobb társadalmi terhet jelentő betegségek azok, melyeknek az előfordulása igen szorosan összefügg az idősödéssel. A krónikus kardiovaszkuláris és neurodegeneratív kórképek együttesen több életet követelnek, mint az összes többi patológiás elváltozás (a rákot is beleértve) vagy akár baleset. Annak érdekében, hogy tisztázzák e destruktív folyamatok és az öregedés közti kapcsolatot, a kutatók az egyes betegségekre jellemző vérfehérjeprofil-elváltozásokat az öregedés újonnan megtalált hullámaival vetették össze. Kiderült, hogy ezek az átrendeződések – klinikailag egészséges alanyokban is – hasonlítanak a betegségekhez köthető mintázatokhoz. Jelenleg nincs birtokunkban olyan gyógyító eljárás, mellyel a krónikus szív-érrendszeri elváltozásokat vagy az Alzheimer-kórt visszafordíthatnánk. Az új eredmények fényében azonban elképzelhető, hogy éppen a természetesnek és elkerülhetetlennek tekintett biológiai öregedés – mint közös, rejtett ok – mélyebb megértése hordozza a kulcsot e kórképek hatékonyabb kezeléséhez.•


























